生体内の酸化還元反応における“電子の運び屋”役のタンパク質
エネルギー獲得のための生物共通の電位制御の仕組みを解明
―水素原子1つが司る“ナノスイッチ機構”の発見―
国立大学法人 茨城大学
国立大学法人 宮崎大学
国立大学法人 大阪大学
学校法人 東京薬科大学
学校法人 久留米大学
茨城県
J-PARCセンター
一般財団法人 総合科学研究機構
公益財団法人 高輝度光科学研究センター
本研究成果は2024年11月15日に国際科学誌『eLife』※1(オンライン)にPreprint版が掲載されました。
発表のポイント
- 生体内で起こる反応の多くは「電子」の移動を伴い、このような反応を酸化還元反応といいます。例えば、呼吸や光合成も酸化還元反応に分類できます。これらの電子の移動を助けるタンパク質の中には鉄と硫黄を含んだものがあります。
- 生体内で「電子の運び屋」として知られているフェレドキシンは、その内部に鉄と硫黄のかたまり(鉄硫黄クラスター)を保持した小さなタンパク質です。フェレドキシンはほとんどすべての生物に存在すると考えられているユニバーサルなタンパク質ですが、これまで、フェレドキシンが電子を安定に運ぶ仕組みは謎に包まれていました。
- 本研究では、中性子線を使った実験で、原子の中で一番小さな水素原子が見えるレベルで、フェレドキシンの精密な立体構造を明らかにすることに成功しました。中性子での精密な構造決定は非常に難易度が高く、タンパク質の立体構造のデータベース(Protein Data Bank; PDB)全体の0.2%以下しか報告例がありません。
- 実験で得られた水素原子の位置情報を含んだ理論計算によって、フェレドキシンの中の鉄硫黄クラスターの電子状態を調べました。その結果、鉄硫黄クラスターから離れた位置にあるアミノ酸残基(アスパラギン酸64番)が鉄硫黄クラスターの電子の授受のしやすさに大きな影響を与え、フェレドキシンの電子の受け渡しを制御するスイッチとなっていることを初めて明らかにしました。さらに、その機構が様々な生物において共通であることを示しました。
- この成果は、生体反応の科学的な理解を深めるにとどまらず、将来的には酸素や窒素の超高感度センサーや新規薬剤の開発への大きな手掛かりになることが期待されます。
背景
生体内では物質と物質の間で常に電子の受け渡しが行われています。物質に電子を与えることを「還元する」といい、物質から電子を引き抜くことを「酸化する」といいます。それらが繰り返される反応を「酸化還元反応」といいます。呼吸や光合成は生体内の酸化還元反応の代表的なものです。
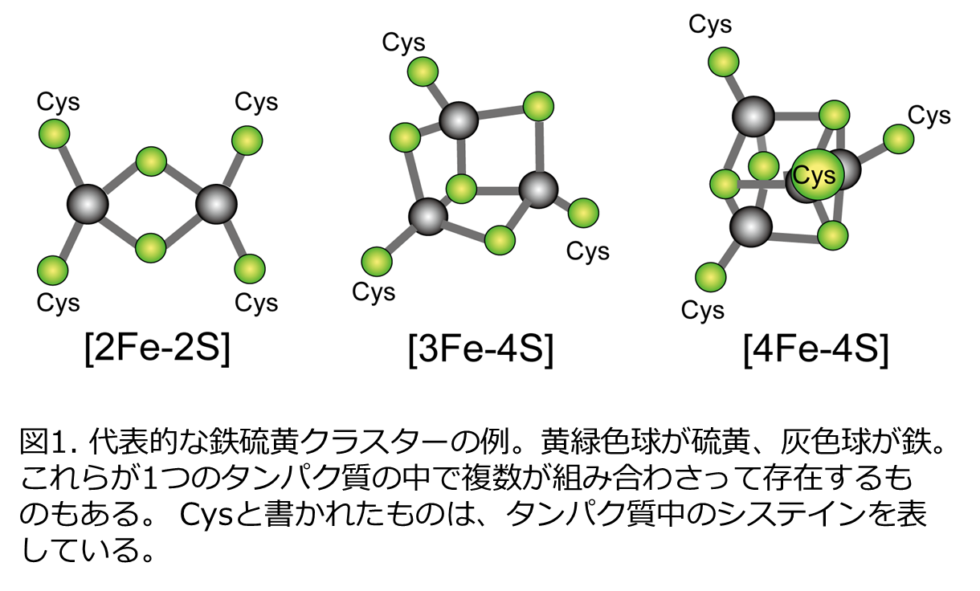
生体内には酸化還元反応を助ける様々なタンパク質が存在しますが、その中には鉄と硫黄のかたまり(鉄硫黄クラスター)を含んだものがあり、この鉄硫黄クラスターこそがタンパク質間の電子の受け渡しにおいて重要な機能を果たしています。フェレドキシンはほとんどすべての生物に存在すると考えられている鉄硫黄クラスターを含んだ小さなタンパク質で、「電子の運び屋」の代表的なものとして知られています。フェレドキシンの発見は非常に古く、60年前にはその機能の研究がスタートしていました。これまでに、構成する鉄と硫黄の数が異なる様々なタイプの鉄硫黄クラスター(図1)をもつフェレドキシンが発見されています。
水は高いところから低いところに流れるのが自然の摂理ですが、電子は「電位」(あるいは静電ポテンシャル)という位置エネルギーの低い方から高い方に流れます。様々なタイプの鉄硫黄クラスターをもつフェレドキシンの電位(酸化還元電位)は多様で広範囲にわたります。あるときは電子を他のタンパク質に与え、あるときは電子をまた別のタンパク質から引き抜くため、フェレドキシンは鉄硫黄クラスターの酸化還元電位をエレベーターのように上げたり下げたりしていますが、それがどのようにコントロールされているかなど、不明な点が多く残されていました。
密度汎関数理論法※2とよばれる方法に基づく計算を駆使すればフェレドキシンの電子状態※3を調べることができますが、正確な計算のためには、水素原子を含めたフェレドキシンの立体構造が必要となります。しかし、タンパク質分子の中の水素原子の位置を決定することは非常に困難であることから、これまでフェレドキシンのみならずほとんどのタンパク質の理論計算では、水素原子の位置は“仮定”で配置することが常法でした。仮定された水素原子の位置が事実と異なれば、理論計算の前提が崩れて得られる結論が無意味なものになります。そこで研究チームは、フェレドキシンの中の水素原子の位置を実験的に決定し、鉄硫黄クラスターの電子状態を実験事実に基づいて解明することに挑みました。
研究手法
現在、タンパク質の立体構造を原子が見える解像度で解析する手法としてX線結晶構造解析法(1962年ノーベル化学賞)やクライオ電子顕微鏡法(2017年ノーベル化学賞)が一般的に使われていますが、これらの手法は原子の中で一番小さな水素原子を同定するのには適していません。また、本年(2024年)ノーベル化学賞を受賞したタンパク質の構造予測アルゴリズム(AlphaFold)でも、現段階では正確な水素原子の位置を予測することは不可能です。そこで本研究では、水素原子をタンパク質中の他の原子と同程度の明確さで同定することが可能な中性子結晶構造解析※4法を利用しました。
本研究では、フェレドキシンの結晶を非常に大きく育てるという高いハードルを克服した上で、茨城県東海村の大強度陽子加速器施設(J-PARC)※5の物質・生命科学実験施設(MLF)内にある茨城県生命物質構造解析装置(iBIX)※6で根気よく中性子を使ったデータを収集しました。
さらに、実験的に精密に決定した立体構造情報を用いて、量子力学・量子化学に基づいた理論計算(密度汎関数理論)によって鉄硫黄クラスターの電子の状態を調べました。得られた結果の検証は、遺伝子を細工してフェレドキシンの中のアミノ酸1つを改変した変異体を試料とし、空気による鉄硫黄クラスターの酸化を防ぐために酸素を極限まで排除したチャンバーの中での実験により進めました。
研究成果
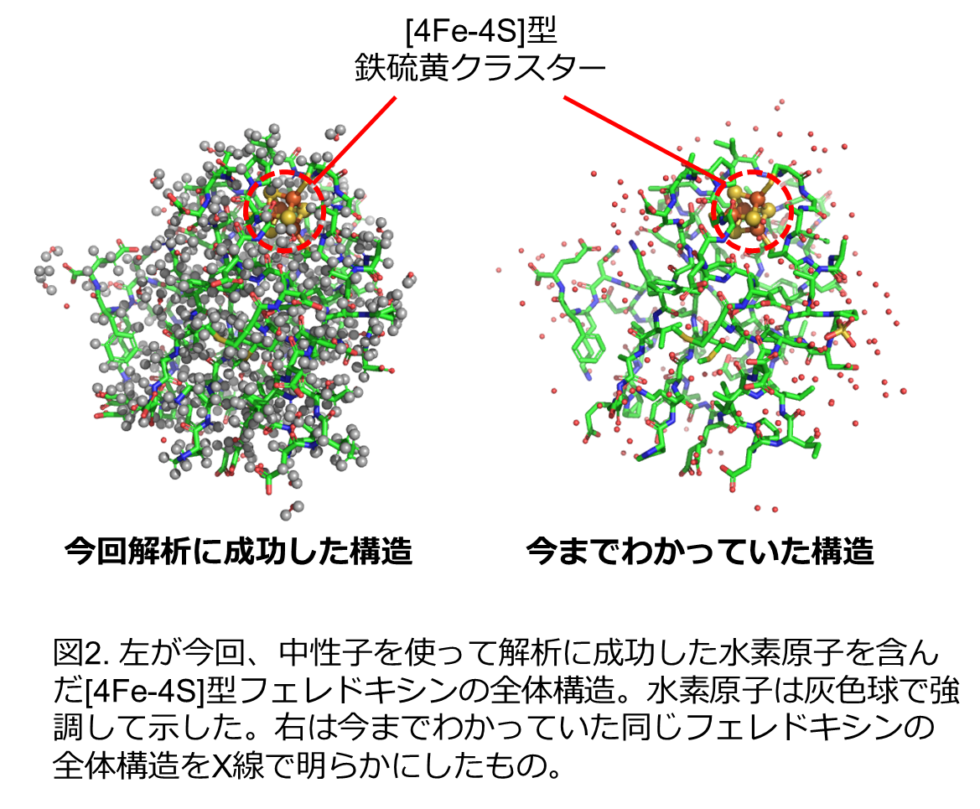
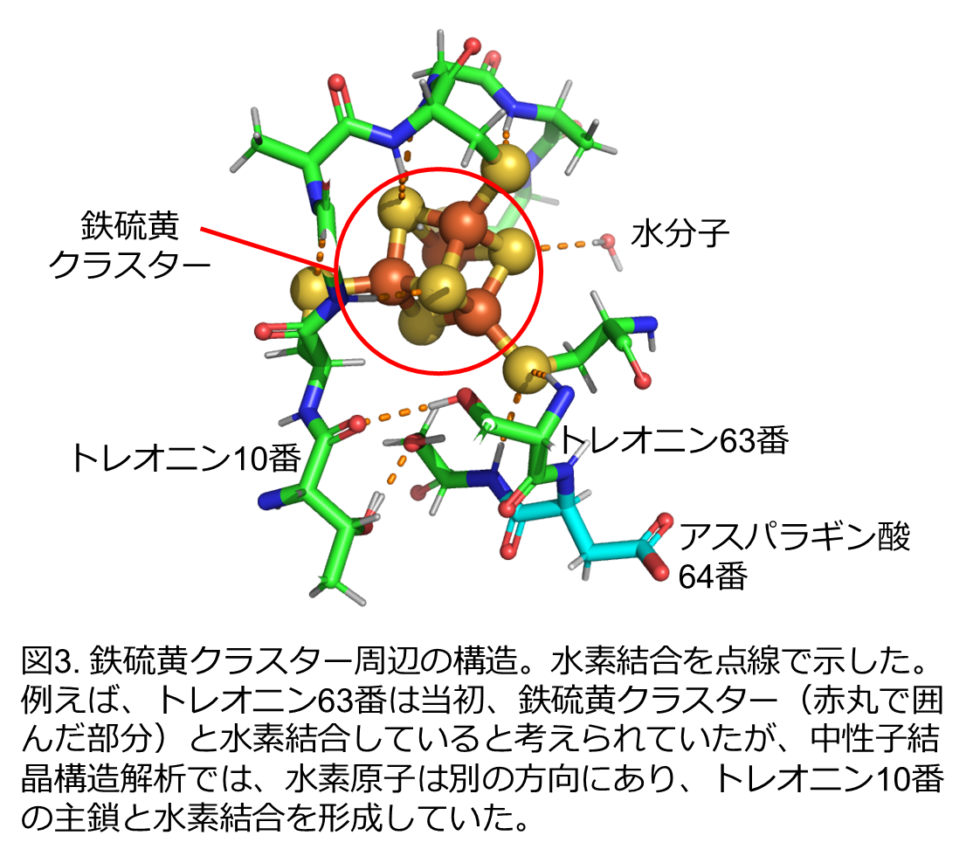
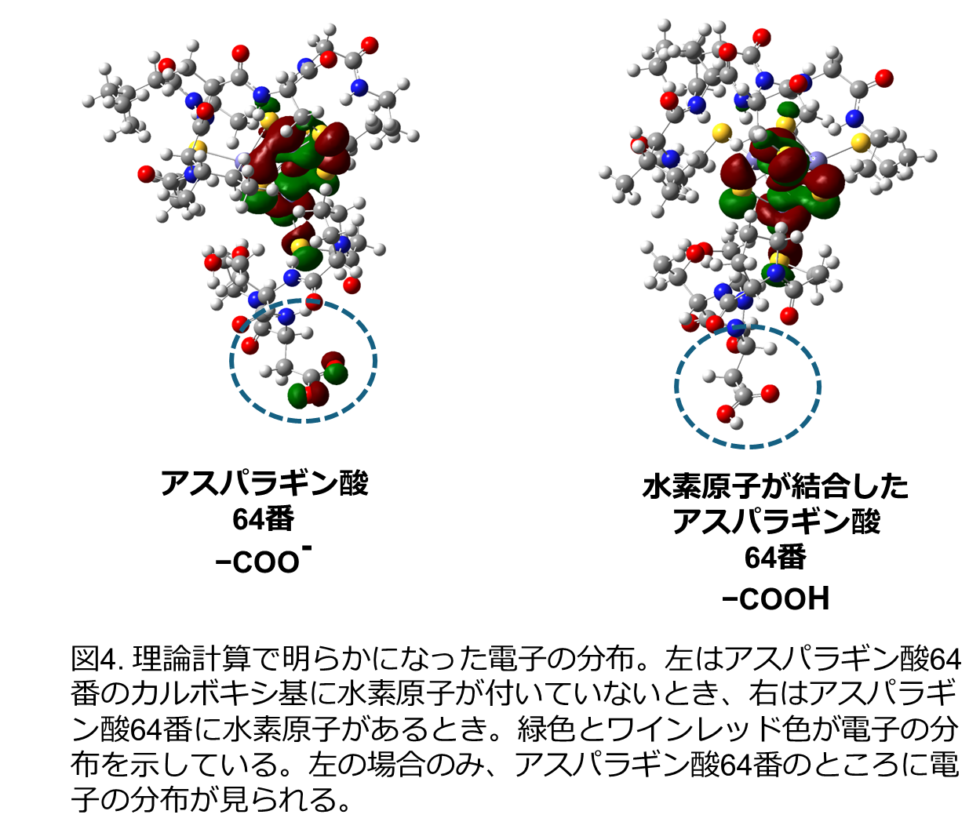
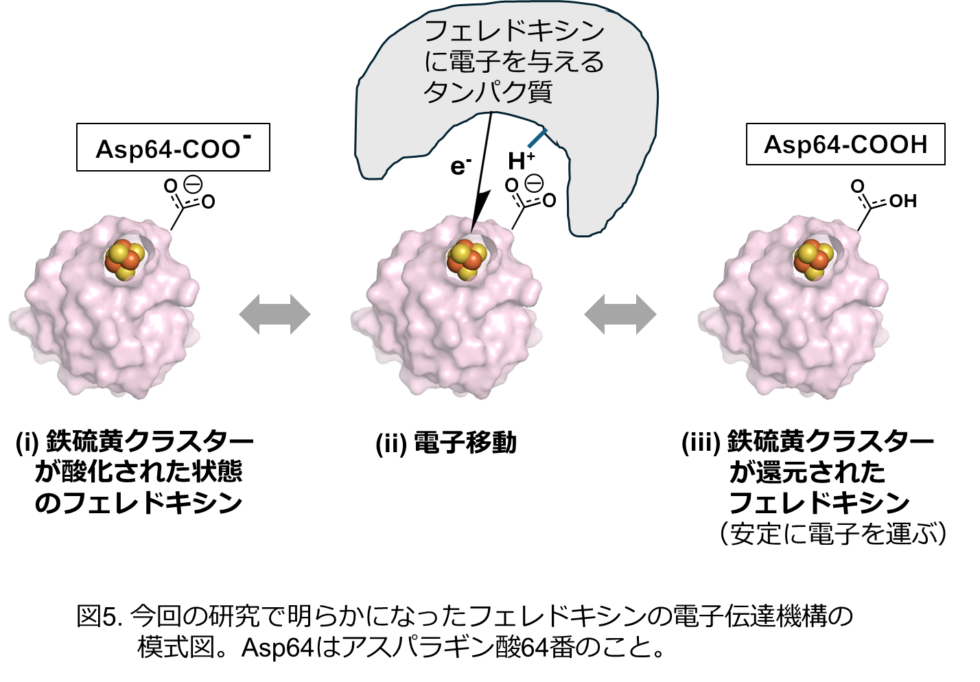
本研究では、分子の中に4つの鉄と4つの硫黄のクラスター([4Fe-4S]型クラスター; 図1)をもつフェレドキシンの立体構造を中性子結晶構造解析により決定し、鉄硫黄クラスター周辺の水素も含めた原子の正確な位置を実験的に明らかにしました(図2)。鉄硫黄クラスター周辺の水素原子の実際の位置は、これまで予測されていた位置とは異なることがわかりました(図3)。その正確な水素原子の位置を踏まえて、鉄硫黄クラスター周辺の電子状態を理論計算により求めたところ、鉄硫黄クラスターに由来する電子は、鉄硫黄クラスター周辺だけなく、1 nm(ナノメートル = 0.000001 mm)以上距離が離れた部位にあるアスパラギン酸64番まで拡がって分布していることを初めて発見しました(図3, 図4)。(1 nmはタンパク質分子の中の距離としては長くて直接相互作用はできません。)興味深いことに、この電子の拡がりは、アスパラギン酸64番の側鎖(カルボキシ基:-COOH)の水素原子がないとき(-COO–)のみに観られ、水素原子があるとき(-COOH)には、電子は鉄硫黄クラスター周辺のみに分布することがわかりました(図4)。実際に、鉄硫黄クラスターが酸化される速度と酸化還元電位を測定することで、アスパラギン酸64番が鉄硫黄クラスターの反応性に大きく影響していることを証明しました。フェレドキシンには複数のアスパラギン酸が含まれていますが、そのような現象が見られたのは、64番目のアスパラギン酸だけでした。さらに、種々の微生物に由来するフェレドキシンにおいても、同様の立体的位置にあるアスパラギン酸残基が鉄硫黄クラスターの電子状態に影響を与えることも明らかにしました。
本研究では、離れた位置にあるアスパラギン酸側鎖の水素原子一つの有無が鉄硫黄クラスターの電子状態を変化させる“ナノスイッチ機構”が存在することを世界で初めて明らかにしました(図5)。また、このナノスイッチ機構は、古細菌でも保存されていることを証明し、生物界で広く利用されていると考えています。
今後の期待
タンパク質の分子の中に含まれる鉄硫黄クラスターは生命活動の根幹を担う様々な反応に関与しています。今回の酸化還元電位の制御スイッチ機構は、それらの反応制御にも応用できます。例えば、生体内で酸素(O2)や一酸化窒素(NO)を検出しているタンパク質では、ごく微量のガスを検知するのは鉄硫黄クラスターです。また、病原性の細菌を含め、多くの微生物ではタンパク質中の[4Fe-4S]型鉄硫黄クラスターがエネルギー獲得において必須な役割を果たしています。さらに最近では、フェレドキシンや鉄硫黄クラスターが癌細胞で重要な働きを担っていることがわかってきました。本研究での発見は、生体反応の科学的な理解を深めるにとどまらず、将来的にはO2やNOの超高感度センサーや新規薬剤(抗がん剤、病原菌に対する抗生物質など)の開発への大きな手掛かりになることが期待されます。
用語説明
※1【eLife誌】
eLife誌は、2012年に生物医学と生命科学のため創刊された非営利のオープンアクセスジャーナルです。比較的新しい雑誌ですが、既にBiology and Biochemistry分野では5位にランキングされています。
https://research.com/journal/elife
※2【密度汎関数理論法】
原子や分子内部の電子状態を求め電子密度からエネルギーを計算する方法論で、DFT(Density Functional Theory)法として広く知られています。比較的少ない計算量で精度良く分子のエネルギーを求めることができるため、タンパク質など大きなサイズの分子にも適用されます。より信頼性の高い計算のためには、正確な分子の構造データが必要となるため、水素原子の座標が実験的に求められることは、大変重要となります。
※3【電子状態】
物質の中で、電子がどのような分布やエネルギーで存在しているかという意味の言葉です。個々の電子の分布関数は分子軌道と呼ばれますが、これを調べることにより、原子間の化学結合の様子や、ひいては分子の性質などを説明することができます。
※4【中性子結晶構造解析】
結晶に中性子を入射し、原子核との相互作用による散乱の強度を調べることにより、結晶内に存在する分子の立体構造を得る解析法。この解析手法では水素原子(あるいは水素イオン)の詳細な観察が可能です。X線結晶構造解析法と似ていますが、X線は電子で散乱を起こすため、電子を1つしか含まない水素原子からの散乱は非常に弱く、水素原子を同定することには向いていません。ただし、X線では小さな結晶でタンパク質の結晶構造解析ができるのに対し、中性子に対しては非常に大きな結晶が必要で、結晶を大きく育成することが非常に大変な実験となっています。クライオ電子顕微鏡法では、X線結晶構造解析法よりは水素原子を同定しやすいのですが、フェレドキシンのような小型のタンパク質には現在のところ適用できません。このフェレドキシンの構造を水素原子レベルで明らかにするには、中性子結晶構造解析が最適でした。
※5【大強度陽子加速器施設(J-PARC)】
国立研究開発法人日本原子力研究開発機構と大学共同利用機関法人高エネルギー加速器研究機構が共同で茨城県東海村に建設し、運用している世界最大規模のビーム強度をもつ陽子加速器群と実験施設群の総称です。加速した陽子を原子核標的に衝突させた時に生じる中性子、ミュオン、中間子、ニュートリノなどの二次粒子を用いて、物質・生命科学、原子核・素粒子物理学などの最先端学術研究及び産業利用を行っています。J-PARC内の物質・生命科学実験施設(MLF)では世界最高強度のパルス中性子及びミュオンビームを利用した実験を行うことができます。
※6【茨城県生命物質構造解析装置(iBIX)】
茨城県がJ-PARC/MLFに設置した2本の中性子ビームラインのうちの一つであり、J-PARC/MLFの大強度パルス中性子ビームを利用して高分解能のタンパク質結晶構造解析が行える、世界最高レベルのパルス中性子単結晶中性子回折装置です。
研究費
本成果は、以下の研究事業・資金的援助により得られたものです。
・文部科学省 科学研究費補助金 学術変革領域研究(A)、基盤研究(B)および基盤研究(C)
・武田科学財団 研究助成、日本応用酵素協会 酵素研究助成、茨城県先導研究事業費
論文情報
| 雑誌名 | eLife |
|---|---|
| 論文タイトル | Protonation/deprotonation-driven switch for the redox stability of low potential [4Fe-4S] ferredoxin |
| 著者 | Kei Wada*, Kenji Kobayashi†, Iori Era†, Yusuke Isobe, Taigo Kamimura, Masaki Marukawa, Takayuki Nagae, Kazuki Honjo, Noriko Kaseda, Yumiko Motoyama, Kengo Inoue, Masakazu Sugishima, Katsuhiro Kusaka, Naomine Yano, Keiichi Fukuyama, Masaki Mishima, Yasutaka Kitagawa*, Masaki Unno* *責任著者 †同一の貢献度 |
| 掲載日 | 2024年11月15日(Preprint版の公開) |
| DOI | 10.7554/eLife.102506 |
研究者の情報
国立大学法人 茨城大学 学術研究院応用理工学野
教授 海野 昌喜
国立大学法人 宮崎大学 医学部
教授 和田 啓
国立大学法人 大阪大学 大学院基礎工学研究科
教授 北河 康隆
東京薬科大学 薬学部
教授 三島 正規
久留米大学 医学部
准教授 杉島 正一
一般財団法人 総合科学研究機構 中性子産業利用推進センター
副主任研究員 日下 勝弘
高輝度光科学研究センター 構造生物学推進室
テニュアトラック研究員 矢野 直峰
本件に関するお問い合わせ先
茨城大学 広報・アウトリーチ支援室(担当:山崎)
TEL: 029-228-8008
E-mail: koho-prg[at]ml.ibaraki.ac.jp
※[at]を”@”に置き換えてください。